
Az új, 3D bionyomtatott gyomorrák modell előrejelzi a gyógyszerválaszokat
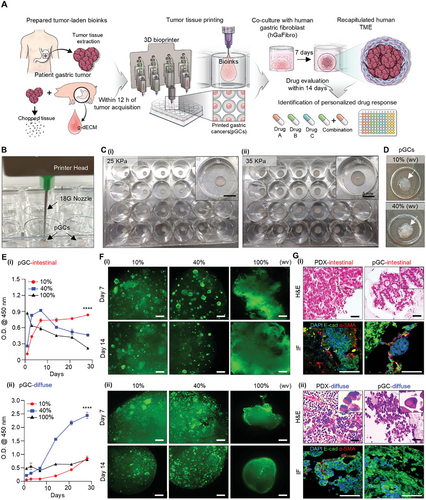
Jinah Jang professzor a POSTECH (Pohang Tudományos és Technológiai Egyetem) Gépészmérnöki és Kreatív Informatikai Mérnöki Tanszékéről, valamint Charles Lee professzor az Egyesült Államok Jackson Genomikai Orvostudományi Laboratóriumából sikeresen kifejlesztett egy gyomorrák modellt 3D bionyomtatási technológia és beteg eredetű rákos szövettöredékek felhasználásával. Ez az innovatív modell megőrzi a tényleges betegszövetek jellemzőit, így segítségével gyorsabban és pontosabban lehet megjósolni a betegek kezelésre történő reagálását. A tanulmány az Advanced Science folyóiratban jelent meg.
A tumor heterogenitása jelentős kihívást jelent a rákterápiák fejlesztésében és kezelésében, mivel a betegek ugyanazon gyógyszerre adott válaszai eltérőek, márpedig a kezelés időzítése kritikus tényező a prognózisban. Ezért a rákellenes kezelések hatékonyságát előrejelző technológiák létfontosságú szerepet játszanak a kezelés pontos célzásában és a mellékhatások minimalizálásában. A meglévő megközelítések, például a génpanel-alapú tesztek és a betegekből származó xenograft (PDX) modellek bizonyos betegeknél csak korlátozottan alkalmazhatók a gyógyszerhatások előrejelzésében, ráadásul idő- és költségigényesek.
A kutatócsoport kifejlesztett egy in vitro gyomorrák modellt a 3D bionyomtatási technológia és a betegből származó szövetfragmenseket tartalmazó szövetspecifikus biotinta felhasználásával. Rákos szöveteket kapszuláztak egy gyomorból származó dECM hidrogélbe[1], mesterségesen lehetővé téve a sejt-mátrix kölcsönhatásokat. Ezeket a szöveteket emberi gyomorfibroblasztokkal (kötőszöveti sejtek) együtt tenyésztették, sikeresen utánozták a rákos sejtek és a sztróma[2] (kötőszöveti váz) kölcsönhatásait, ezáltal in vitro[3] újrateremtve az in vivo[4] tumor mikrokörnyezetet.
Ez a modell bebizonyította, hogy képes megőrizni az egyes betegek gyomorszöveteinek egyedi jellemzőit mind a sejt-sztróma, mind a sejt-mátrix kölcsönhatások lemásolásával. Nagyon pontosnak bizonyult a beteg rákellenes gyógyszerválaszának és prognózisának előrejelzésében. Ezenkívül a modell génprofiljai a rák kialakulásával, progressziójával és gyógyszerválaszával kapcsolatban a hagyományos OPDX modelleknél jobban hasonlítottak a betegek szöveteinek profiljaira. A bionyomtatással történő gyors gyártási módszer lehetővé teszi a gyógyszerezés értékelését a tumorszövet betegből történő kivonását követő két héten belül. Ez a hatékony platform várhatóan jelentősen hozzájárul a személyre szabott rákkezelések fejlesztéséhez.
Charles Lee, a kutatást vezető professzor megállapította: „A rákos sejt-sztróma és sejt-mátrix kölcsönhatások reprodukálásával ez a modell növeli a gyógyszerválasz előrejelzéseinek pontosságát, és csökkenti a szükségtelen gyógyszeradagolást a nem reagáló betegek számára.”
Jinah Jang, a POSTECH professzora pedig a kutatás további jelentőségét hangsúlyozta: „Ez a preklinikai platform a jövőben nemcsak a betegspecifikus kezelések kifejlesztéséhez, hanem az új rákellenes gyógyszerek és kombinált terápiák validálásához is használható.”
[1] A decellularizált extracelluláris mátrix (dECM) hidrogélek szövetspecifikus mikrokörnyezetet biztosítanak.
[2] (STROH-muh) Azok a sejtek és szövetek, amelyek a szervezetben a szerveket, mirigyeket vagy más szöveteket támogatják és struktúrát adnak nekik . A stróma többnyire kötőszövetből, vérerekből, nyirokerekből és idegekből áll. Tápanyagot biztosít a szövet vagy szerv számára, és eltávolítja a hulladékot és a felesleges folyadékot.
[3] Az in vitro („üvegben”) végzett vizsgálat azt jelenti, hogy azt élő szervezeten kívül végzik, és általában izolált szövetekre, szervekre vagy sejtekre terjed ki.
[4] Az in vivo szó szerinti jelentése: élőben. Élő szervezetben elvégzett vizsgálatok, illetve testen belül zajló biológiai folyamatok megjelölésére használják.
